Mise au point
Aspects épidémiologiques et cliniques des lésions vulvaires non invasives squameuses

Marine JOSTE
Auteurs : M. Joste, K. Nyangoh-Timoh, V. Lavoué, J. Levêque.
Département de Gynécologie Obstétrique et Reproduction Humaine, CHU Anne de Bretagne, 16 Bd de Bulgarie BP 90 347, F-35 203 Rennes Cedex 2 France
Généralités – Nosologie
Les Vulvar Intraepithelial Neoplasia (VIN) ont été décrites il y a près de 100 ans et leurs différentes appellations rendent compte du caractère protéiforme des ces lésions (John T. Bowen en 1912, "dyskératose érythroplasiforme de la muqueuse vulvaire" en 1922, Carcinome In Situ en 1943 séparé en CIS de Bowen et CIS simplex en 1961, atypie bowenoïde en 1973, papulose bowenoïde en 1979, VIN en 1982, VIN 1 2 3 en 1989 avec en sus le type différencié...) : actuellement la classification internationale de l'ISSVD (International Society for the Study of Vulvar Diseases) prévaut et l'on distingue [1, 2] :
- les lésions de bas grade vulvaires : L-SIL vulvaire, vL-SIL (correspondant aux condylomes acuminés ou effet HPV) en relation avec une infection HPV bas risque et dont l'évolution est bénigne,
- les lésions de haut grade vulvaires qui touchent entre 2.5 à 8.8 / 100,000 Femmes et qui sont divisées en :
o vH-SIL (ou VIN de type usuel, représentant 86.7% des VIN dans les séries scandinaves [3]) en relation avec une infection HPV à haut risque et dont l'évolution peut conduire au cancer vulvaire (28.6% dans les mêmes séries scandinaves [3]),
o lésions de VIN Différenciées (dVIN) se développant sur une dermatose chronique (lichen) et à plus haut risque d'évolution maligne.
Il est important de comprendre les fondements de cette classification :
- les experts internationaux ont voulu adopter une classification commune aux lésions squameuses anogénitales basses "LAST" (Lower Anogenital Squamous Terminology) distinguant :
o les lésions de bas grade (Low Grade Squamous intraepithelial Lesions, L-SIL) qui n'évoluent pas vers la malignité (ce que pouvait laisser supposer leur ancienne dénomination "intraepithelial neoplasia") et ne justifient d'être traitées que lorsqu'elles sont symptomatiques (ce qui signifient donc qu'elles doivent tout de même être suivies...),
o les lésions de haut grade (High Grade Intrepithelial Lesions, H-SIL) susceptibles d'évoluer vers la malignité et justifiant donc d'un dépistage, d'un traitement lorsqu'elles sont diagnostiquées et d'un suivi,
- toutefois, en pathologie vulvaire, les lésions de haut grade peuvent être en relation soit avec une infection HPV haut risque (vH SIL vulvaire ou VIN usuelle) soit un lichen (mais avec aussi la possibilité qu'un HPV haut risque cohabite sans être responsable de la lésion vulvaire) et l'on parlera alors de VIN différenciée (dVIN),
- cette classification des lésions squameuses ne permet plus de mélanger aux lésions H-SIL les mélanomes in situ ni les maladies de Paget vulvaires comme l'imposait la classification VIN,
- cette classification a permis de simplifier pour les cliniciens la nosologie en ne se basant plus sur des descriptions cliniques, comme par exemple la papulose bowenoïde (lésions multifocales de la femme jeune) et la maladie de Bowen (lésions plus souvent unifocales extensives de la femme plus âgée).
Epidémiologie analytique et descriptive
Dans un souci de clarté, nous distinguerons 3 types de lésions squameuses :
- les lésions de bas grade vL-SIL,
- les lésions de haut grade, HPV induites vH-SIL,
- les lésions squameuses non HPV induites dVIN.
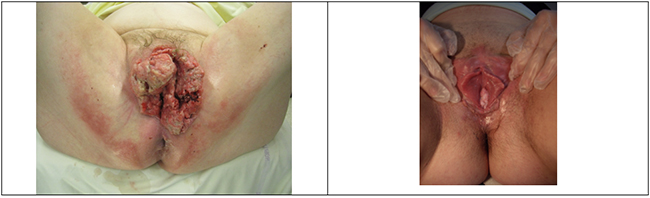
Les lésions de bas grade (v L-SIL). On distingue 2 types cliniquement, les condylomes acuminés, et une forme particulière, géante, la tumeur de Buschke-Lowenstein. Ces lésions n'évoluent pas vers la malignité, et sont liées à un infection à HPV 6 et 11 dans près de 90% des cas [4] :
- l'infection se transmet par contact direct précocement,
- le contact infectant est responsable de lésions dans 60 à 70% des cas [5],
- parmi les cofacteurs on retient le tabagisme avec un effet dose et un effet-durée, ainsi que l'immuno-dépression (taux de CD4+) [6-8].
Elles sont fréquentes, affectant 107 patientes pour 100,000 dans une étude effectuée chez des médecins généralistes français [9], et jusqu'à 228.9 patientes entre 15 et 65 ans pour 100,000 dans une étude française réalisée dans des cabinets de gynécologie [10].
Figures 1a&b. Yumeur de Buschke Lowenstein et condylomes acuminés.
Les lésions de haut grade HPV induites vH-SIL. Elles sont directement liées aux infections HPV haut risque : dans une étude internationale menée par de Sanjose [11], la prévalence de la détection d’HPV dans les lésions de VIN (n = 587) était de 86.7% oscillant entre 93.0% chez les moins de 37 ans et 76.7% chez les plus de 62 ans. Les génotypes HPV 16 était le plus fréquemment rencontré (77.2%) suivi par les génotypes 33 (10.6%), 18 (2.6%), 31 (1.2%). Une méta-analyse récente [12] retrouve des chiffres voisins : prévalence de 86.2% [95% IC : 73.5 – 95.5] d’HPV dans les vH-SIL (356 cas recensés dans 10 études), contre 2.0% [95% IC : 0 – 10.0] dans les dVIN, avec peu ou prou la même répartition génotypique (HPV 16 : 83.9% [95% IC : 79.3 – 88.1], HPV 33 : 7.5% [95% IC : 5.0 – 10.4], HPV 18 : 1.2% [95% IC : 0.3 – 2.5]. Parmi les facteurs de risque de développement des lésions de haut grade, on retrouve les facteurs classiquement associés aux lésions HPV-induites dans la NIH – AARP Study [13] : le mode de vie (le fait d’être séparée versus mariée – HR = 1.77 [95% IC : 1.24 – 2.51], la contraception orale – HR = 1.46 [95% IC : 1.06 – 2.01, le traitement hormonal de ménopause – HR = les vH-SIL ont un risque de cancérisation moindre que les formes dVIN avec un délai de cancérisation plus important (cf infra).
Les lésions squameuses non HPV induites dVIN. La physiopathologie de ces lésions diffère totalement des vH-SIL HPV-induites : elles se développent sur des lésions pré-existantes de lichen scléreux, touchent en conséquence des femmes plus âgées (60-80 ans versus 30 – 50 ans en cas de vH-SIL), parmi les mécanismes évoqués on retient l’inflammation chronique, le stress ischémique et oxydatif [14], et les mutations p53 sont monnaie courante [15] ; en tout état de cause, si l’on retrouve de l’HPV, il n’est en rien responsable des lésions (sa prévalence étant comparable à celle observée dans la population générale à tranche d’âge comparable, 2.0% [95% IC : 0. 10.0] comme déjà évoqué dans la méta-analyse de Faber [12]).
Une étude de cohorte historique hollandaise [16] apporte un éclairage intéressant sur les rapports entre lichen scléreux / VIN différenciée / cancer vulvaire invasif (étude courant de 1991 à 2001, portant sur 3,038 femmes porteuses d’un liche scléreux) :
- l’incidence moyenne du lichen scléreux était de 10.4 / 100 000 années femme (avec une incidence maximale de 28.6 chez les 65-69 ans)
- 2.6% des femmes ayant un lichen scléreux ont développé un carcinome invasif vulvaire dans un délai médian de 3.3 ans (après 5 ans : 2.1% [95%IC : 1.5 – 2.7], après 10 ans : 3.3% [95%IC : 2.5 – 4.1], après 15 ans 4.1% [95%IC : 3.2 – 5.1], après 20 ans : 6.7% [95%IC : 4.0 – 9.4],
- mais l’association au lichen scléreux d’un dVIN concomitant augmente considérablement le risque : à 10 ans le risque de développement d’un carcinome vulvaire squameux à partir d’un lichen scléreux isolé est de 2.8% [95% IC : 2.0 – 3.6] alors qu’il croit à 18.8% [9.2 – 28.4] en cas de lichen scléreux associé à un dVIN.
Ces données sont corroborées par une étude italienne portant sur 976 cas de lichen scléreux (âge moyen de 60 ans et suivi moyen de 52 mois) : 34 patientes ont développé des lésions (14 lésions pré-malignes et 20 cancers invasifs), soit une incidence globale de lésions de 3.5% soit 8.1 /1000 année – femme ; la probabilité cumulée de progression vers des lésions néoplasiques (dVIN et cancer invasif) était de 1.2% à 2 ans et de 36.8% à 25 ans [17].
Les séries anatomo-pathologiques s’étant intéressées aux lésions associées aux carcinomes vulvaires kératinisées retrouvent constamment des lésions de lichen scléreux avec une composante dVIN : cette dernière est donc un précurseur de nombreux carcinomes vulvaires non HPV-induits [18, 19].
Le lichen plan est une dermatose chronique inflammatoire auto-immune ayant une prévalence de 1 à 2% dans la population générale qui intéresse la peau extra-génitale et génitale, dont les rapports avec le cancer invasif vulvaire est évoqué dans la littérature en particulier car le risque de cancérisation des muqueuses ORL et œsophagienne intéressées par le lichen plan serait de 5 % ; la plus grande série publiée est autrichienne unicentrique concernant 38 cas de carcinomes vulvaires squameux invasifs associés à des lésions de lichen plan [20] : les cancers invasifs de cette série étaient d’une particulière gravité avec une atteinte ganglionnaire dans 42% des cas et une évolution défavorable (30% de décès spécifiques et 40% de récidives, mais les lésions présentées étaient de taille conséquente). La même équipe dans une publication ultérieure note 16 cas de VIN différenciée sur 584 cas de patientes ayant un lichen plan (3%) [21], et conclut au faible risque évolutif du lichen plan. Enfin, plus récemment une équipe australienne met en doute l’association du lichen plan au carcinome invasif squameux HPV négatif vulvaire en notant l’absence de lichen plan dans les 43 cas de cancers invasifs vulvaires non HPV induits et en soulignant les difficultés du diagnostic différentiel entre les formes érosives et hypertrophiques du lichen plan et les VIN différenciées [22].
Figure 2. Lichen plan.
L'évolution des lésions de haut grade vulvaire vH-SIL et dVIN.
Clairement les lésions dVIN ont un potentiel évolutif plus péjoratif que les lésions vH-SIL (qui évoluent vers l'invasion dans 3 à 5% des cas si elles sont traitées et 10% [23]) :
- une petite série [24] a comparé l'évolution de 7 cas de dVIN (âge moyen de 75 ans) et 18 cas de vH-SIL : 6 dVIN avaient évolué vers des lésions malignes malgré le traitement dans un délai moyen de 1.9 ans, tandis qu'aucun cas de vH-SIL n'avait progressé vers l'invasion (au prix tout de même de récidives locales),
- une deuxième publication récente basée sur les registres des pathologistes hollandais (extraction des données sur 14 années) retrouvait un risque de cancérisation des lésions vH_ SIL de 5.7% (augmentant avec l'âge) comparé au risque de 32.8% des dVIN [25]
- une dernière publication émanant des Pays Bas [26] et portant sur 318 patientes avec un carcinome invasif squameux vulvaire a comparé les cancers HPV positif (17%) et HPV négatif (83%) :
o âge plus jeune, tabagisme, et immunodépression étaient significativement plus fréquents dans le groupe HPV +, tandis que le lichen scléreux était retrouvé chez 41% des patientes HPV – (contre 10% en cas de cancers HPV+),
o le pronostic des tumeurs non HPV induites était plus sombre (36% de récidives et 72% de décès spécifique contre 20% et 50% dans les lésions HPV+) en accord avec une accumulation de facteurs histopronostiques défavorables dans le groupe HPV- (taille tumorale, profondeur d'invasion, atteinte vasculo-lymphatique et ganglionnaire).
Au total existent 2 types de lésions squameuses pré-malignes qui diffèrent totalement en termes de physiopathologie, terrain, devenir (évolution vers la malignité, gravité des cancers invasifs résultant de l'évolution).
Figure 3. Représentation schématique de l'oncogénèse vulvaire.

Les présentations cliniques
L'interrogatoire est le début de l'examen clinique et peut retrouver des signes d'appels non spécifiques :
- prurit avant toute chose,
- douleurs en particulier lors des rapports avec une dyspareunie superficielle ou d'intromission volontiers à type de brûlures,
- saignements provoqués qui doivent inquiéter (risque d'invasion),
- suintements en particulier dans la région péri-anale.
L'intensité des symptômes est corrélée à la gravité des lésions : ainsi les lésions de bas grade sont asymptomatiques dans 30% des cas. Ces signes lorsqu'ils sont chroniques évoquent de prime abord une pathologie se développant sur un lichen alors que, intermittents, ils orientent vers une pathologie virale HPV-induite.
Bien sur, l'interrogatoire recherchera des éléments étiologiques en faveur de lésions vH-SIL ("contexte HPV") ou de dVIN (pathologie dermatologique comme le lichen).
L'examen clinique de la région vulvaire doit être exhaustif : il faut donc tout regarder, en déplissant la région vulvaire et anale, sans oublier les aires ganglionnaires inguinales et le pubis. L'examen gynécologique du vagin et du col est indispensable en particulier dans un contexte viral : les frottis cervicaux et anaux doivent être pratiqués. Le rendu de l'examen dermatologique doit être rigoureux :
- les photographies sont aujourd'hui de pratique courante,
- la description des lésions doit avoir la rigueur des observations dermatologiques qui précisent les sites / nombre / tailles / formes / couleur / épaisseurs des lésions,
- l'examen des autres sites susceptibles d'être la cible de l'HPV est nécessaire : anus, vagin et col avec réalisation de frottis cervico-utérin et biopsie des lésions suspectes.
La vulvoscopie est de pratique courante en consultation mais de manière surprenante peu analysée : une étude américaine d'un centre de référence [27] a évalué la valeur de l'examen colposcopique 3 minutes après application d'acide acétique à 3% chez des patientes jeunes (34 ans en moyenne, ce qui sous-entend une sur-représentation des lésions HPV induites) référées pour une pathologie vulvaire ; toutes les patientes ayant eu une biopsie sur les zones suspectes à l'œil nu ou après blanchiment post acide acétique. La sensibilité de la colposcopie est très élevée (97%) et la spécificité médiocre (40%) avec une valeur prédictive positive de 37% : on retrouve là à peu de choses près les performances de la colposcopie dans les lésions cervicales. La colposcopie après acide acétique doit donc être pratiquée largement : chez les patientes symptomatiques chez qui l'on ne voit rien à l'œil nu, mais aussi chez les patientes présentant des lésions multifocales (donc a priori vH-SIL) afin d'avoir une cartographie plus précise en reconnaissant des lésions infra-cliniques, ceci au prix de biopsies négatives (volontiers dans les zones de frottement ou de grattage).
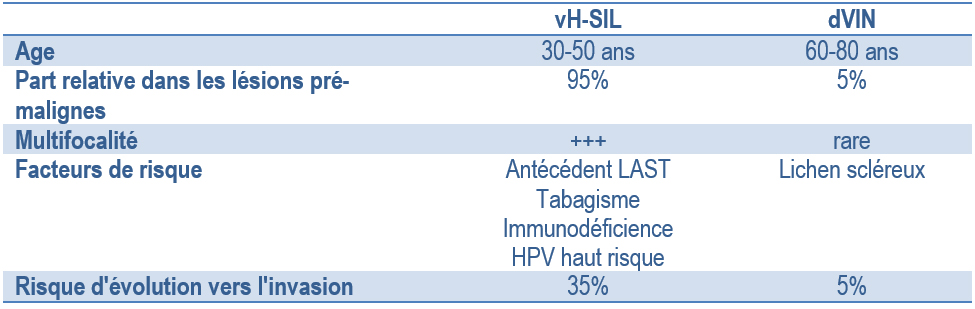
Schématiquement (car la symptomatologie typique peut être modifiée par des lésions de grattage, des surinfections ou des traitements hasardeux...) on peut distinguer [14, 23, 28] (Tableau 1) :
Les lésions vH-SIL
- patiente entre 30 – 50 ans ayant des antécédents de LAST (41.2% des cas [25])
- le signe majeur : prurit intermittent mais 20% des patientes sont asymptomatiques
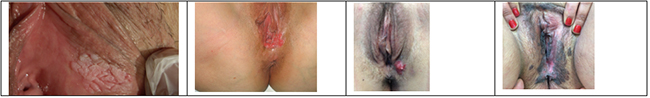
- lésions multifocales et d'aspect différent les unes des autres dans plus de 50% des cas en particulier en cas d'immuno-dépression associée avec alors un aspect extensif vers l'anus et le vagin [29] – proches de l'introïtus (fourchette vulvaire, grande lèvre) – maculaires ou papulaires plus rarement exophytiques pouvant faire évoquer des condylomes mais sans caractère acuminé – à limites nettes mais formant des plaques irrégulières plus ou moins coalescentes – de couleur variable selon les lésions : opalines, érythémateuses, pigmentées,
Figures 4a&b&c&b. Lésions vH-SIL : lésions leucoplasique maculo-papulaire ; lésion érytrhoplasique maculaire ; lésion acuminée avec micro-invasion ; maladie de Bowen.
Les dVIN
- patiente plus âgée (60 – 80 ans) ayant une dermatose inflammatoire chronique ancienne (lichen scléreux) sans antécédents HPV (2.9% [25]),
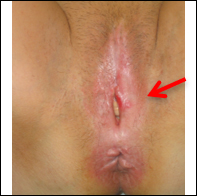
- symptomatologie fonctionnelle riche mais s’étant renforcée récemment : prurit parfois féroce avec lésions de grattage et phénomènes hémorragiques dermiques, douleur chronique avec impression de peau qui « se déchire », sécheresse et dysparéunie, voire saignements ce qui constitue un signe d’alerte faisant craindre des lésions invasives,
- plaques extensives : rouges brillantes légèrement surélevées lorsqu’elles sont sur la muqueuse vestibulaire, plus épaisses blanches comme décolorées en bordure de la zone muqueuse, d’aspect maculo-papuleux finement papillomateux vers la peau ; l’aspect final est celui d’un placard aux limites précises mais irrégulières érythro-leucoplasiques de surface vallonnée avec rides et fissures en particulier dans les zones les plus épaisses.
Figure 5. dVIN avec invasion débutante.
Tableau 1. Les présentations cliniques des vH-SIL / dVIN.
Dans tous les cas, la biopsie est la clé du diagnostic : le geste est aisé, indolore après une
anesthésie locale et ne pose guère de problème de cicatrisation. Elle est impérative lorsqu'existent des signes de gravité : apparition d'ulcérations, ou au contraire bourgeonnements, extension rapide centrifuge.
Conclusion
En 2018, la nosologie des lésions vulvaires squameuse se répartit en 3 types de lésions :
- à bas risque en relation avec une infection HPV à bas risque sans gravité évolutive,
- pré-malignes soit HPV induites (HPV haut risque) soit se développant sur un lichen scléreux.
Ces lésions sont loin d'être exceptionnelles, ne bénéficient pas d'un dépistage, et restent victimes de tabous ; ceci explique les retards diagnostiques, et la stabilité de l'incidence des cancers vulvaire : il faut convaincre nos patientes (et surtout les plus âgées) que l'examen vulvaire est partie intégrante d'une consultation gynécologique et que toute symptomatologie vulvaire n'est pas nécessairement une mycose...
Un examen clinique (interrogatoire et examen physique) sérieux permet dans la majorité des cas de distinguer les différents types de lésions. Toutefois, en particulier dans les lésions pré-malignes, une biopsie cutanée reste indispensable : le diagnostic anatomo-pathologique seul autorise un traitement volontiers éprouvant pour la patiente (qu'il soit médical ou chirurgical) et permet de proposer un suivi adapté au type lésionnel.
Déclaration publique d’intérêts
Les auteurs déclarent ne pas avoir de d’intérêt en relation avec le sujet présenté.
Références bibliographiques
[1] Bornstein J, Bogliatto F, Haefner HK, Stockdale CK, Preti M, Bohl TG, et al. The 2015 International Society for the Study of Vulvovaginal Disease (ISSVD) Terminology of Vulvar Squamous Intraepithelial Lesions. Obstet Gynecol. 2016;127:264-8.
[2] Yang EJ, Kong CS, Longacre TA. Vulvar and Anal Intraepithelial Neoplasia: Terminology, Diagnosis, and Ancillary Studies. Adv Anat Pathol. 2017;24:136-50.
[3] Nygard M, Hansen BT, Dillner J, Munk C, Oddsson K, Tryggvadottir L, et al. Targeting human papillomavirus to reduce the burden of cervical, vulvar and vaginal cancer and pre-invasive neoplasia: establishing the baseline for surveillance. PLoS One. 2014;9:e88323.
[4] Leonard B, Kridelka F, Delbecque K, Goffin F, Demoulin S, Doyen J, et al. A clinical and pathological overview of vulvar condyloma acuminatum, intraepithelial neoplasia, and squamous cell carcinoma. Biomed Res Int. 2014;2014:480573.
[5] Handsfield HH. Clinical presentation and natural course of anogenital warts. Am J Med. 1997;102:16-20.
[6] Madsen BS, Jensen HL, van den Brule AJ, Wohlfahrt J, Frisch M. Risk factors for invasive squamous cell carcinoma of the vulva and vagina--population-based case-control study in Denmark. Int J Cancer. 2008;122:2827-34.
[7] McIntyre-Seltman K, Castle PE, Guido R, Schiffman M, Wheeler CM, Group A. Smoking is a risk factor for cervical intraepithelial neoplasia grade 3 among oncogenic human papillomavirus DNA-positive women with equivocal or mildly abnormal cytology. Cancer Epidemiol Biomarkers Prev. 2005;14:1165-70.
[8] von Krogh G. Management of anogenital warts (condylomata acuminata). Eur J Dermatol. 2001;11:598-603; quiz 4.
[9] Lukasiewicz E, Aractingi S, Flahault A. Incidence et prise en charge des condylomes acuminés externes en médecine générale. Ann Dermatol Venereol. 2002;129:991-6.
[10] Monsonego J, Breugelmans JG, Bouee S, Lafuma A, Benard S, Remy V. Incidence, prise en charge et coût des condylomes acuminés anogénitaux chez les femmes consultant leur gynécologue en France. Gynecol Obstet Fertil. 2007;35:107-13.
[11] de Sanjose S, Alemany L, Ordi J, Tous S, Alejo M, Bigby SM, et al. Worldwide human papillomavirus genotype attribution in over 2000 cases of intraepithelial and invasive lesions of the vulva. Eur J Cancer. 2013;49:3450-61.
[12] Faber MT, Sand FL, Albieri V, Norrild B, Kjaer SK, Verdoodt F. Prevalence and type distribution of human papillomavirus in squamous cell carcinoma and intraepithelial neoplasia of the vulva. Int J Cancer. 2017;141:1161-9.
[13] Brinton LA, Thistle JE, Liao LM, Trabert B. Epidemiology of vulvar neoplasia in the NIH-AARP Study. Gynecol Oncol. 2017;145:298-304.
[14] Preti M, Scurry J, Marchitelli CE, Micheletti L. Vulvar intraepithelial neoplasia. Best Pract Res Clin Obstet Gynaecol. 2014;28:1051-62.
[15] Pinto AP, Miron A, Yassin Y, Monte N, Woo TY, Mehra KK, et al. Differentiated vulvar intraepithelial neoplasia contains Tp53 mutations and is genetically linked to vulvar squamous cell carcinoma. Mod Pathol. 2010;23:404-12.
[16] Bleeker MC, Visser PJ, Overbeek LI, van Beurden M, Berkhof J. Lichen Sclerosus: Incidence and Risk of Vulvar Squamous Cell Carcinoma. Cancer Epidemiol Biomarkers Prev. 2016;25:1224-30.
[17] Micheletti L, Preti M, Radici G, Boveri S, Di Pumpo O, Privitera SS, et al. Vulvar Lichen Sclerosus and Neoplastic Transformation: A Retrospective Study of 976 Cases. J Low Genit Tract Dis. 2016;20:180-3.
[18] Chiesa-Vottero A, Dvoretsky PM, Hart WR. Histopathologic study of thin vulvar squamous cell carcinomas and associated cutaneous lesions: a correlative study of 48 tumors in 44 patients with analysis of adjacent vulvar intraepithelial neoplasia types and lichen sclerosus. Am J Surg Pathol. 2006;30:310-8.
[19] van der Avoort IA, Shirango H, Hoevenaars BM, Grefte JM, de Hullu JA, de Wilde PC, et al. Vulvar squamous cell carcinoma is a multifactorial disease following two separate and independent pathways. Int J Gynecol Pathol. 2006;25:22-9.
[20] Regauer S, Reich O, Eberz B. Vulvar cancers in women with vulvar lichen planus: a clinicopathological study. J Am Acad Dermatol. 2014;71:698-707.
[21] Regauer S, Eberz B, Reich O. Human Papillomavirus-Induced Squamous Intraepithelial Lesions in Vulvar Lichen Planus. J Low Genit Tract Dis. 2016;20:360-4.
[22] Day T, Otton G, Jaaback K, Weigner J, Scurry J. Is Vulvovaginal Lichen Planus Associated With Squamous Cell Carcinoma? J Low Genit Tract Dis. 2018;22:159-65.
[23] Allbritton JI. Vulvar Neoplasms, Benign and Malignant. Obstet Gynecol Clin North Am. 2017;44:339-52.
[24] McAlpine JN, Kim SY, Akbari A, Eshragh S, Reuschenbach M, von Knebel Doeberitz M, et al. HPV-independent Differentiated Vulvar Intraepithelial Neoplasia (dVIN) is Associated With an Aggressive Clinical Course. Int J Gynecol Pathol. 2017;36:507-16.
[25] van de Nieuwenhof HP, Massuger LF, van der Avoort IA, Bekkers RL, Casparie M, Abma W, et al. Vulvar squamous cell carcinoma development after diagnosis of VIN increases with age. Eur J Cancer. 2009;45:851-6.
[26] Hinten F, Molijn A, Eckhardt L, Massuger L, Quint W, Bult P, et al. Vulvar cancer: Two pathways with different localization and prognosis. Gynecol Oncol. 2018;149:310-7.
[27] Santoso JT, Likes W. Colposcopic acetowhitening of vulvar lesion: a validity study. Arch Gynecol Obstet. 2015;292:387-90.
[28] Hoang LN, Park KJ, Soslow RA, Murali R. Squamous precursor lesions of the vulva: current classification and diagnostic challenges. Pathology. 2016;48:291-302.
[29] Bradbury M, Cabrera S, Garcia-Jimenez A, Franco-Camps S, Sanchez-Iglesias JL, Diaz-Feijoo B, et al. Vulvar intraepithelial neoplasia: clinical presentation, management and outcomes in women infected with HIV. AIDS. 2016;30:859-68.