Prise en charge chirurgicale primaire des cancers de l’endomètre : Recommandations SFOG-CNGOF

Émile DARAÏ
INTRODUCTION
Le Collège National des Gynécologues et Obstétriciens Français (CNGOF) et la Société Française d’Oncologie Gynécologique (SFOG) ont décidé d’élaborer en collaboration des référentiels pour le traitement des cancers de l’endomètre, en excluant la prise en charge des récidives et le traitement des sarcomes utérins - tout en gardant les carcinosarcomes, qui rentrent dans le cadre des carcinomes endométriaux.
Ces recommandations sont à considérer comme une actualisation des recommandations publiées sous l’égide de l’Institut National du Cancer en 2011 (1), ainsi que des recommandations d’une conférence de consensus européenne co-organisée par les sociétés d’oncologie médicale, de radiothérapie et d’oncologie gynécologique (ESMO, ESTRO, ESGO) publiées en 2015 (2).
Le traitement suit un processus lié à la place centrale du traitement chirurgical dans la thérapeutique et de l’analyse histopathologique de la pièce opératoire pour la détermination des besoins de traitement adjuvant. La décision pré-opératoire est donc principalement une planification du geste chirurgical et tout particulièrement de la stadification, dont le rapport bénéfice-risque doit être évalué. Cette décision thérapeutique initiale est prise en fonction des informations provisoires, certes imparfaites mais seules disponibles issues du bilan pré-opératoire (stade, type histologique, grade), ce qui conduit à une première stratification des risques en trois catégories qui permet de moduler le traitement chirurgical. Cette stratification est issue de la classification FIGO en vigueur (Tableau 1).
La décision de traitement adjuvant est prise en fonction des informations définitives issues de l’analyse de la pièce opératoire, avec une deuxième stratification des risques. L’évaluation est alors plus précise, pour deux raisons :
1 - Il peut exister des discordances entre les estimations pré-opératoires des éléments de pronostic (essentiellement le grade et l’infiltration myométriale) et le résultat définitif ;
2 - Certaines caractéristiques pronostiques sont uniquement accessibles à l’examen microscopique de la pièce (emboles lymphatiques (EL) et micro-métastases ganglionnaires).
BILAN PRÉ-OPÉRATOIRE
L’interrogatoire (antécédents chirurgicaux, comorbidités, antécédents familiaux du spectre Lynch), l’examen clinique (vagin, col, paramètres, volume utérin, mobilité, aires ganglionnaires, abdomen), complétés, en cas de patiente âgée vulnérable, une évaluation oncogériatrique, sont indispensables. L’échographie pelvienne transvaginale et transpariétale est l’examen de tri indispensable en cas de métrorragies avec col sain. Chez la femme ménopausée, une épaisseur endométriale de plus de 5 mm a une sensibilité de 90% et une spécificité de 54% pour le diagnostic de cancer de l’endomètre. Si le seuil est abaissé à 3 mm, la sensibilité augmente à 98%, au prix d’une réduction de spécificité à 35%10. Le seuil de 4 mm a été choisi par un groupe d’étude américain11.
En cas d’anomalie échographique, la biopsie à la pipelle en consultation, ou si cette dernière est non réalisable ou non contributive une hystéroscopie avec biopsie dirigée, ou un curetage, sont les moyens d’obtenir l’indispensable diagnostic histologique, complété par la détermination du grade OMS qui doit être fourni par le pathologiste, en prenant en compte la composante la plus agressive. La cytologie n’a pas de place. Même s’il existe environ 20% de discordances entre l’appréciation pré-opératoire du type histopathologique et du grade et le diagnostic définitif sur pièce opératoire, il n’y a pas de bénéfice à réaliser une hystéroscopie en regard du prélèvement à la pipelle en consultation. Le dosage du marqueur Ca125 n’est pas recommandé en pratique.
Lorsque le diagnostic est posé, le principal élément du bilan d’extension est une IRM abdomino-pelvienne incluant les aires ganglionnaires. Alternativement, une échographie 3D peut être utilisée, mais seulement par des experts. C’est seulement en cas d’impossibilité de l’IRM qu’un scanner abdomino-pelvien peut être indiqué. Ce bilan utérin et ganglionnaire permet de proposer une estimation du stade FIGO.
En l’absence d’évidence d’adénopathies, le stade FIGO doit être interprété en stratifiant les situations en trois catégories : bas risque, risque intermédiaire, ou haut risque (Tableau 2), correspondant à un risque croissant d’atteinte ganglionnaire microscopique. La recherche de métastases extra-pelviennes est indiquée seulement dans les cas à haut risque. Elle nécessite soit un PET-scan soit à défaut un scanner thoraco-abdomino pelvien. Une dissémination péritonéale de la maladie est décelée dans 10 à 20% des cas à haut risque histologique. La sensibilité de la TEP-TDM est supérieure à celle du scanner, sans réduction de spécificité.
TRAITEMENT CHIRURGICAL
Traitement de l’utérus et des annexes
Au stade I, l’hystérectomie totale (avec exérèse complète du col utérin), non élargie, sans colpectomie, avec annexectomie bilatérale, est l’intervention type. La conservation ovarienne (avec salpingectomie) peut être envisagée chez les femmes de moins de 45 ans en cas de cancer endométrioïde de grade 1 ou 2 avec infiltration myométriale inférieure à 50%, hors haut risque familial et en particulier circonstances évocatrices de syndrome de Lynch.
ur le plan technique, il existe des preuves du bénéfice de la chirurgie minimale invasive en termes de suites opératoires et de coût-efficacité, avec à ce jour la démonstration de son équivalence oncologique avec la chirurgie ouverte. L’utilisation de manipulateurs utérins n’est pas délétère. La chirurgie laparoscopique robot-assistée peut avoir un intérêt pour éviter la conversion en cas d’obésité morbide mais le risque de conversion reste limité à 8% des cas même en cas d’IMC supérieur à 403. Il n’existe pas de preuve de son bénéfice par rapport à la chirurgie coelioscopique en regard de son coût dans les autres cas.
Dans les stades I, la voie vaginale est admise de nécessité dans les cas rares de contre-indication à un abord coelioscopique. A noter que les hyperplasies atypiques, qui sont accompagnées dans une proportion non négligeable de cas d’adénocarcinomes débutants, sont traitées de la même manière.
Au stade II, l’hystérectomie totale avec annexectomie bilatérale reste l’opération de référence. Ni l’hystérectomie élargie ni la colpectomie ne sont recommandées en routine. Cependant, le but de la chirurgie étant d’obtenir une exérèse en zone saine, une hystérectomie élargie type A ou B peut être nécessaire pour des raisons techniques, ou lorsqu’il existe un doute sur l’origine endométriale ou cervicale de la tumeur.
Dans les stades avancés (III et IV), il reste une place pour la chirurgie à la condition qu’une exérèse macroscopiquement complète soit possible, ce qui peut nécessiter au besoin une hystérectomie élargie, une colpectomie, une chirurgie de carcinose péritonéale en milieu spécialisé, ou une chirurgie d’exérèse de ganglions pathologiques. En cas de risque chirurgical élevé ou si la chirurgie implique une altération importante de la qualité de vie, il sera discuté en RCP spécialisée et en consultation d’annonce la chimiothérapie et/ou la radiothérapie dans le cadre d’un traitement multimodal.
Lymphadénectomie
Si une lymphadénectomie est réalisée, elle doit comprendre l’étage pelvien et aortico-cave. Le curage lombo-aortique doit être complet et remonter jusqu’à la veine rénale gauche car l’atteinte du seul niveau supramésentérique est observé dans 35% des cas d’atteinte ganglionnaire aortique. Dans le cas général, le curage pelvien doit également être complet, en incluant les régions iliaques communes et présacrées, mais à l’exclusion du ganglion circonflexe iliaque (le ganglion latérovasculaire le plus proche de l’arcade fémorale) qui est rarement atteint isolément44 et dont l’exérèse semble être associée à une augmentation du risque de lymphoedème.
La chirurgie minimale invasive, par voie transpéritonéale ou extrapéritonéale doit être privilégiée pour la réalisation des curages, qu’ils soient réalisés dans le même temps opératoire ou dans le cadre d’une restadification.
Hors atteinte ganglionnaire macroscopique, les curages sont réalisés dans un but de stadification. L’effet thérapeutique d’une lymphadénectomie de routine en cas de stade précoce n’est pas démontré.
La technique du ganglion sentinelle a été validée dans une étude prospective et a maintenant atteint la maturité. Elle peut être réalisée par méthode combinée isotopique et colorimétrique ou préférentiellement par fluorescence au vert d’indocyanine. L’examen extemporané des ganglions sentinelles, par un pathologiste expérimenté est suffisamment fiable pour orienter la suite de la stadification : le curage au moins lombo-aortique est indiqué lorsque le ganglion sentinelle est positif, le curage n’est pas nécessaire lorsque le ganglion sentinelle est négatif. Il n’y a pas de consensus sur l’intérêt d’un curage pelvien complet en présence d’un ganglion sentinelle pelvien positif.
La stratification des risques (Tableau 2) oriente l’indication :
- Les curages ne sont pas recommandés pour les cancers endométrioïdes de bas risque.
- Il y a néanmoins une place possible pour un ganglion sentinelle dans les bas risques, en particulier si la taille tumorale dépasse 3.5 cm (selon les données de la littérature), cependant sans curage complémentaire en cas d’échec de détection puisqu’il s’agit là d’une indication limite. La justification du geste est l’existence reconnue de maladie ganglionnaire microscopique même en cas de bas risque, ainsi que la possible sous-estimation du risque à la suite des examens pré-opératoires. Cependant, la rareté de l’atteinte ganglionnaire dans les ganglions non sentinelles même en présence de micrométastases ne justifie pas les risques associés au curage.
- Pour les cancers endométrioides à risque intermédiaire (G1-2, stade IB ou G3 stade IA) : en l’absence de donnée convaincante de la littérature, il n’y pas de recommandation proposée mais dans le contexte français la procédure du ganglion sentinelle est privilégiée, en attendant les résultats de l’étude randomisée nationale Sentirad.
- Les curages complets sont recommandés dans les cancers endométrioides à haut risque ainsi que dans les stades II cliniques et autres types histologiques. A noter que la technique du ganglion sentinelle a également été validée dans cette indication57-59.
Autres gestes de stadification
Une omentectomie de stadification et des biopsies péritonéales selon les recommendations en vigueur pour les cancers de l’ovaire sont indiquées pour les carcinomes séreux. L’omentectomie infracolique est suffisante dans ce contexte diagnostique. Il n’y a pas de standard pour les autres types II.
Cas particulier : indications de restadification
En cas de découverte sur l’histologie définitive d’un carcinome à haut risque non diagnostiqué en pré-opératoire, il est recommandé d’adresser le dossier à une RCP d’oncologie gynécologique spécialisée pour discuter d’une deuxième chirurgie de stadification. L’indication sera fonction du risque d’atteinte ganglionnaire, de la faisabilité de la stadification, de la faisabilité des traitements adjuvants, et des implications thérapeutiques possibles en fonction des résultats de la stadification chirurgicale. Une évaluation oncogériatrique est indiquée après 75 ans.
Pour documenter cette décision, une imagerie d’extension (PET-scan ou à défaut scanner thoraco-abdomino-pelvien) doit être réalisée si elle ne l’a pas été initialement. Si des localisations ganglionnaires ou métastatiques sont détectées, il n’y a pas d’indication de restadification. En revanche, en cas de bilan négatif et sous réserve de l’absence de haut risque chirurgical, on discutera une stadification ganglionnaire complémentaire (lombo aortique avec ou sans curage pelvien).
La même logique s’applique en cas de découverte d’un risque intermédiaire haut.
En conclusion, la chirurgie reste la pièce angulaire du traitement du cancer de l’endomètre. Nous n’avons pas abordé la place du traitement adjuvant dont les indications sont disponibles dans les nouvelles recommandations (3).
TABLEAUX
Tableau 1. Classification FIGO et correspondances TNM
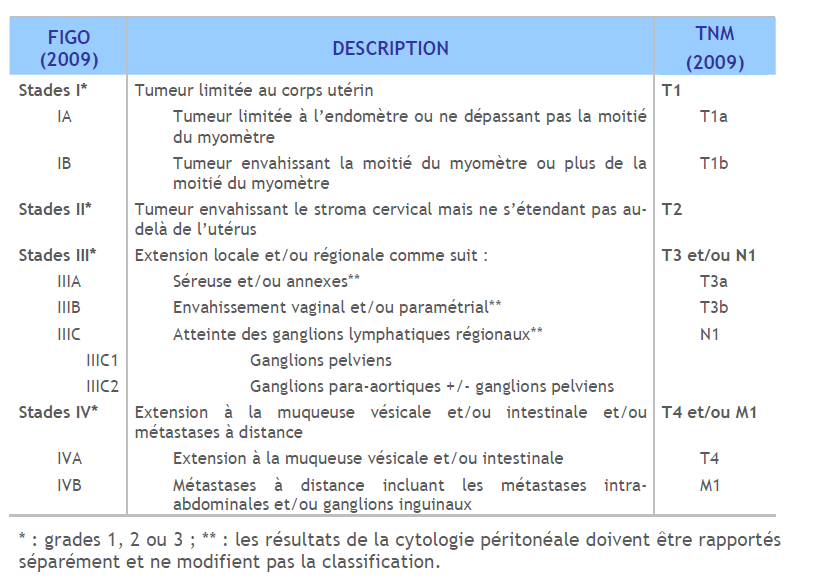
Tableau 2. Définition de groupes de risque basés sur le bilan pré-opératoire
|
Risque bas |
Risque intermédiaire |
Risque élevé |
|
|
|
|
|
Endométrioïde stade IA G1-2 |
Endométrioïde stade IAG3, IB G1-2 |
Endométrioïde stade IB, G3 Stades ≥ II Non endométrioïde |
Tableau 3. Définition de groupes de risque basés sur la pathologie définitive
|
Risque bas |
Risque intermédiaire |
Risque intermédiaire haut |
Risque élevé |
|
|
|
|
|
|
Endométrioïde stade IA G1-2 EL- |
Endométrioïde stade IB G1-2 EL- |
Endométrioïde stade IA-B G1-2 EL+ Endométroïde stade IA G3 |
Endométrioïde stade IB, G3 Stades ≥ II (tous grades) Non endométrioïde |
Auteurs :
E. Darai1, F. Lecuru2, A. Rafii3, E. Chereau4, P. Collinet5, P. Crochet6, H. Marret7, E. Mery8, L. V. Villefranque9, L Thomas10, F. Planchamp10, D. Querleu10
1 Hôpital Tenon, Paris
2 Hôpital européen Georges Pompidou, Paris
3 Weill Cornell Medicine in Qatar et Hôpital Foch, Paris
4 Hôpital privé Beauregard, Marseille
5 Centre hospitalier régional universitaire, Lille
6 Hôpital de la Conception, Marseille
7 Centre hospitalier régional universitaire, Tours
8 Institut Claudius Regaud, Toulouse
9 Centre hospitalier René Dubos,
10 Pontoise Institut Bergonié, Bordeaux
BIBLIOGRAPHIE
1. Querleu, D., et al. Clinical practice guidelines for the management of patients with endometrial cancer in France: recommendations of the Institut National du Cancer and the Societe Francaise d'Oncologie Gynecologique. Int J Gynecol Cancer 21, 945-950 (2011).
2. Colombo, N., et al. ESMO-ESGO-ESTRO Consensus Conference on Endometrial Cancer: Diagnosis, Treatment and Follow-up. Int J Gynecol Cancer 26, 2-30 (2016)
3. Querleu D, Darai E, Lecuru F, Rafii A, Chereau E, Collinet P, Crochet P, Marret H, Mery E, Thomas L, Villefranque V, Floquet A, Planchamp F. Primary management of endometrial carcinoma. Joint recommendations of the French society of gynecologic oncology (SFOG) and of the French college of obstetricians and gynecologists (CNGOF)]. Gynecol Obstet Fertil Senol. 2017 Dec;45(12):715-725.







