ERA, PGT-A, IMSI, … Les professionnels de santé devraient être plus prudents avant de promouvoir ces « innovations scientifiques magiques » conçues sans supports scientifiques établis

Yves MÉNÉZO

Edouard SERVY
INTRODUCTION
La procréation médicalement assistée (PMA) a généré un nombre important de pratiques, qui ont été très largement promues, faisant rapidement l’objet de modes, alors qu’elles étaient peu ou pas étayées scientifiquement. Les centres de FIV se voyaient alors contraints de les utiliser, parfois poussés par les patients, afin de ne pas paraitre « has been » et déclassés.
Certaines de ces pratiques largement utilisées, ayant un coût important pour les patients ou, pour la société, se révèlent au mieux inutiles, voire assez fréquemment contre-productives et pénalisantes pour les couples.
Nous présentons ici un aperçu de ces techniques/assertions, présentées comme des « Milestone » : tournants majeurs, qui de fait ne le sont pas et présentent souvent même un recul parfois important quant au but recherché en procréation médicalement assistée, à savoir, l’obtention d’enfants sains, dans le cadre d’un moindre trauma des couples impliqués.
PGT-A : test pré-implantatoire pour aneuploïdie
En première approche, l’idée du DPI-A est basé sur l’hypothèse suivante : les études sur les produits de fausses couches révélant des taux d’aneuploïdie très élevés, une sélection des embryons euploïdes aux stades précoces réduirait le taux d’échecs d’implantation et de fausses couches. Un premier écueil réside dans l’innocuité d’un tel prélèvement, par essence très opérateur dépendant. Puis le fait que le taux de mosaicisme est très élevé, dans les embryons préimplantatoires obtenus en FIV en constitue un deuxième. Alors se pose un problème crucial : l’absence de groupe control in vivo, quel est le statut chromosomique des embryons « fertiles » et à capacité de développement important in vivo ?
Puis se pose le problème du prélèvement au stade 8 cellules : prélèvement d’une cellule euploïde ou aneuploïde, non représentative de l’embryon ? Les cellules à contenu chromosomique « anormal », peuvent se trouver éliminées lors de l’éclosion, se retrouver dans le trophoblaste puis dans le placenta sans poser de problème bien qu’une aneuploïdie du placenta peut poser problème : ex trisomie 16 confinée au placenta . L’embryon euploïde dans cette situation se développera normalement, l’aneuploïdie peut sans doute être considéré comme une « anecdote ». Dans cette même veine, les embryons « déclassés » suite à des biopsies aux stades précoces montrent un retour à une certaine normalité au stade blastocyste (Veiga et al. 1999 ).
Ces observations font surgir une question sur l’intérêt de la biopsie aussi au stade blastocyste : les mécanismes d’autocorrection se réalisent à tous les stades préimplantatoires (voir plus loin Munne et al.2020).
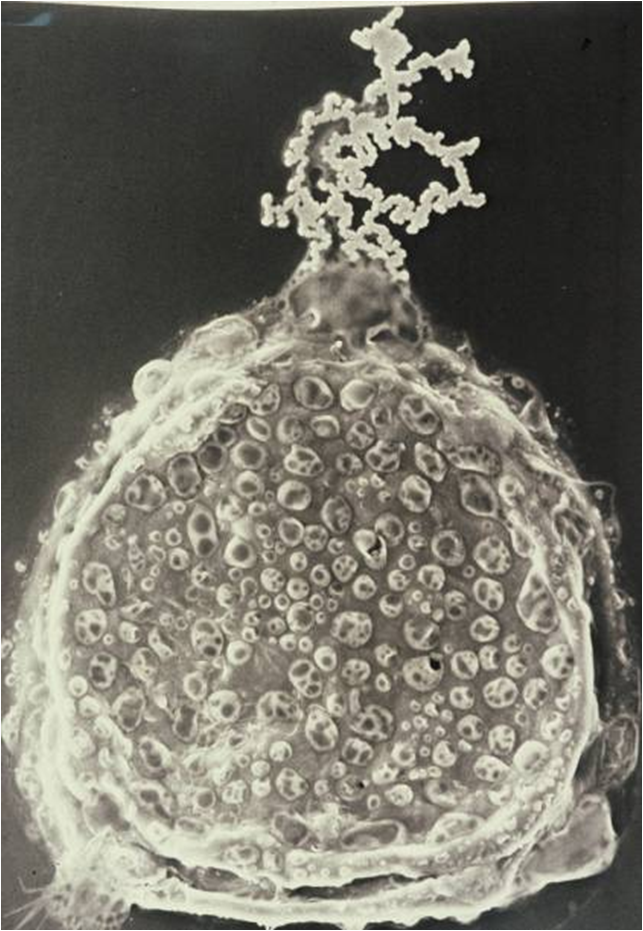
Blastocyste éclos montrant l’hétérogénéité cellulaire
La localisation du prélèvement pourra donner lieu nécessairement, à la fiabilité du résultat. Les cellules du trophoblaste pouvant être euploïdes et celles du bouton embryonnaire aneuploïdes et vis versa ; par ailleurs des processus de réparation de l’ADN existent (Ménézo et al. 2010). Une démonstration incontournable a été apportée à partir du modèle murin en 2016.
L’aneuploïdie/mosaïque, présente aux stades préimplantatoires, ne pose pas de problème pour le développement ultérieur à terme (Bolton et al. 2016). Enfin, dans une étude, par ailleurs éthiquement contestable, des blastocystes, récupérés par « lavage utérin », après conception et début de développement in vivo, montrent des taux d’euploïdie et de mosaicisme tout à fait similaires (Munne et al. 2020). Seules les morphologies semblant un peu meilleures pour les blastocystes obtenus in vivo.
Ce retour aux critères morphologiques n’est pas vraiment un progrès et ne nécessite pas de passer pas l’étape DPI-A. Face à ces doutes quant à la validité de la technique Il a été ensuite postulé, par les défenseurs du DPI-A qu’il pourrait être utile pour les femmes de plus de 35 ans, compte tenu du fait que les risques d’aneuploïdie sont naturellement plus élevés. Ces « supputations » ont été démenties (Patrizio et al. 2019, Gleicher et al. 2020).
Les conclusions sont simples : un grand nombre d’embryons viables ont été non transférés donc perdus, du fait de cette technique, pour le moins inappropriée. Les mécanismes d’auto-correction chromosomique ont été clairement explicités. Le transfert d’embryons mosaïques au stades précoces permet d’obtenir des enfants parfaitement sains avec des taux similaires à ceux obtenus post DPI-A, point final, comme cela a été démontré et répété à de nombreuses reprises (Gleicher et al. 2017 a et b, Patrizio et al. 2019). L’association PGT-A ERA test s’est révélé également totalement improductive voire délétère pour les LBR (live Birth rate), pourcentage d’accouchement des enfants sains.
Le paradoxe montre clairement que cette « sélection » embryonnaire, qui n’en est pas une, mais plutôt un trauma cellulaire, est encore proposée, bien trop souvent, aux patients dans les pays où elle est autorisée. Quant à son utilisation, à des fins de recherche, comme cela est proposé comme ultime justification, on n’en voit pas clairement ni l’intérêt ni les tenants et les aboutissants.
ERA (Endometrial receptivity Array)
Comme la « ploidy » de l’embryon, normale ou anormale, n’est pas du tout un critère de sélection, la tentative d’amélioration des LBR (live Birth rate), pourcentage d’accouchement des enfants sains a amené certains professionnels de FIV à créer un espace pour des tests de réceptivité de l’endomètre. Cette idée a une certaine cohérence : la réceptivité endométriale doit être synchrone du développement embryonnaire. Déjà, les essais sur les biopsies endométriales ont montré une très forte 1-hétérogénéité, 2-une très forte opérateur-dépendance (Murray et al. 2004, Coutifaris 2004). Ceci aurait déjà dû inciter les promoteurs de nouvelles techniques de détermination de la fenêtre d’implantation à la prudence. La transcriptomique (238 gènes), associée à « l’intelligence artificielle », très à la mode a conduit au test ERA. Le test ERA devait permettre un ajustement/adaptation du timing du transfert embryonnaire chez des patients à échecs répétés d’implantation ; selon les auteurs ERA test permet de suivre la « progression endométriale ». Les résultats, présentés par les promoteurs eux même du test (Cozzolino et al. 2020, 2022) sont simplement catastrophiques. Non seulement l’apport quant aux LBR n'est pas positif mais il est négatif, avec une perte nette de grossesses à terme, « although the ERA test can accurately detect endometrial progression (Cozzolino 2022)” , bien que ERA peut mettre en évidence, selon les auteurs, « la progression de la réceptivité endométriale », dont on ne sait pas très bien ce qu’elle signifie vue que les résultats semblent plutôt la démentir. Sachant que plus de 150000 tests ont été effectués…le nombre de grossesses perdues se chiffre probablement à plusieurs centaines (1000 grossesses perdues, c’est 0.6%)
TLT, Time Lapse Technology (estimation de la cinétique de développement embryonnaire pré-implantatoire)
Le concept semble simple et séduisant. La cinétique du développement embryonnaire précoce est analysée en continu ; divers paramètres morphologiques et cinétiques sont analysés, et rapportés rétrospectivement a l’obtention ou non de la grossesse (à l’aide de l’intelligence artificielle ! encore une fois). Immédiatement on se heurte à des obstacles incontournables notamment l’absence de contrôle in vivo… Puis vient le problème de la qualité du développement embryonnaire et le problème de l’acquisition de l’épigénèse, dorénavant clairement mis en évidence. Quelques paramètres physio-biochimiques doivent être rappelés.
Le développement embryonnaire précoce est régi, jusqu’au stade 4-8 cellules, par les protéines et les ARN messagers accumulés dans l’ovocyte lors de sa croissance et sa maturation. Il n’y a que très peu de transcription ; elle intéresse les chromosomes Y et X, mais pas la machinerie cellulaire (« house Keeping »). Le génome paternel est en quelque sorte « dormant ». Lors de ces 3 premiers jours de développement impliquant les premières divisions cellulaires, un équilibre se produit entre la traduction des ARNs messagers stockés dans l’ovocyte et le maintien de l’épigénèse, essentiellement via la méthylation de l’ADN (méthylation maintenance) et, dans une moindre mesure, des histones. Il y a peu de méthylations de novo. Ces régulations équilibrées Traduction/épigénèse assure un développement embryonnaire harmonieux (Ménézo et al ,2022, Dvorak 2022) , notamment quant à sa cinétique. C’est à ce niveau qu’intervient un problème majeur avec le TLT. Les milieux de FIV actuel ne permettent pas le maintien d’une épigénèse correcte (Market Velker et al, 2010,2012). Aussi, concernant la vitesse de développement : « les embryons a développement le plus rapide sont les meilleurs » est totalement fallacieuse, la rapidité de développement se fait au dépend du maintien des marques de l’épigénèse ; ce problème n’est absolument pas pris en compte par le TLT. Si les paramètres morphologiques sont également pris en compte, il est évident qu’il y a une interférence morphologie/ cinétique : on est là totalement à l’origine des effets paternels et maternels, souvent liés à des problèmes de méthylation….
Un autre point complètement passé sous silence est l’impact de la lumière en continu sur l’embryon, condition tout à fait non physiologique s’il en est. Ce problème a été soulevé bien avant l’avènement du TLS (Schultz 2007, Takenaka et al. 2007), et est remis à l’ordre du jour (Campugan et al. 2022) La lumière est source d’énergie et source de Stress oxydant (ROS, reactive oxygen species : radicaux libres). Chez la souris, la lumière peut affecter la vitesse de développement et le métabolisme des lipides. Le stress oxydant affecte la régulation correcte de l’épigenèse. Donc comment définir des critères de qualités et de timing dans un contexte où, de plus, les milieux sont au départ incapable d’assurer un équilibre correct entre traduction des ARNs messagers et méthylation épigénétique (Market Velker et al ; 1 et2), et qui sont inducteurs de stress oxydant (Martin Romeo) dans un environnement lui-même générateur de stress oxydant. L’aspect épigénétique est complètement ignoré, alors qu il s’agit là d’une source récurrente d’inquiétude pour les bébés FIV (voir Helosvuori E & Homanen 2022) : il s’agit-là d’un abus de confiance. En tout état de cause, la synthèse des études comparatives rétrospectives ne montrent pas d’intérêt significatif du système time Lapse (Park et al 2015, Armstrong et al 2019).
Les Milieux de culture : Le concept erroné de la toxicité des aminoacides essentiels
Ce concept est basé sur deux concepts erronés à savoir 1- plus le développement embryonnaire pré-implantatoire est rapide, meilleure est la qualité embryonnaire, 2- les acides aminés essentiels dont Methionine, Cysteine et arginine, qui ralentissent cette vitesse de développement, sont « toxiques » pour l’embryon (Gardner and Lane , Lane et al.1997,2001). Ces deux assertions sont totalement contredites par plusieurs observations. Tout d’abord Ho et al, 1995 montrent que les acides aminés essentiels ne changent que marginalement la cinétique, et permettent de réaliser une méthylation de gènes importants tout à fait similaire à celle observée in vivo.
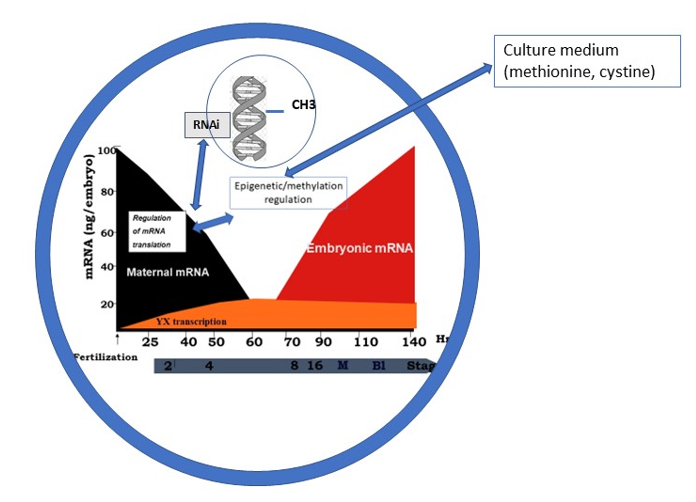
Équilibre des relations entre maintien des marques épigénétiques et traduction des ARN messagers stockés pendant la croissance et la maturation ovocytaire
Rôle de la méthylation et des ARNi (micro ARNs interférants)
La vitesse de développement se fait au détriment de la régulation épigénétique (Merket Velker et al., 2010,2012). Les acides aminés essentiels sont des moteurs et des régulateurs de l’épigénèse, notamment via la synthèse de la S Adenosyl Méthionine, cofacteur universel de la méthylation (notamment de l’ ADN et des histones). L’arginine, précurseur de la synthèse des polyamines est un régulateur de la méthylation. La cystéine, précurseur du glutathion est un protecteur contre les stress oxydant en général mais aussi et surtout protecteur des marquages épigénétiques (Menezo et al. 2015 ).
Ce concept de la toxicité des aminoacides essentiels a d’ailleurs a été démenti par les faits : les aminoacides essentiels ne sont pas toxiques pour les embryons aux stades précoces de la vache, la souris et les félins. Encore plus dérangeant quant à ce concept, Clare et al. (2021) démontrent que la faible concentration en méthionine dans l’environnement ovocytaire et embryonnaire, chez les bovins affecte directement la méthylation de nombreux gènes… plus de 1600, dont certains soumis à empreinte. La démonstration est à la fois incontournable et dramatique, mais également source d’inquiétude en FIV humaine (Choux et al.2018, Lazaraviciute, G et al. 2014, Hattori t al. 2019, Haberg et al. 2022).
Il est largement temps de mettre à plat la composition des milieux de culture, notamment en s’éloignant de concepts infondés, appuyés sur aucune base biochimique, pouvant affecter la santé des enfants et des petits enfants, sachant que les phénomènes d’empreinte peuvent sauter les générations en fonction du sexe.
Concepts de moindre importance
L’IMSI (sélection des spermatozoïdes à fort grandissement) a été un moment à la mode. Elle est censée permettre un choix des spermatozoïdes a morphologie parfaite, censé être parfait quant à leur capacité pour un bon développement embryonnaire. Les résultats sont confus mais n’indiquent aucun intérêt quant à son utilisation ; certains résultats quant à la relation entre « meilleure morphologie » et intégrité de la méthylation globale de l’ADN (Cassuto et al 2016) ne vont pas du tout dans le bon sens : le taux global de méthylation des spermatozoïdes à « morphologie parfaite » est le plus faible !
L’éclosion assistée au Laser : L’idée de départ consiste à trouer la zone pellucide afin de faciliter l’éclosion du blastocyste, sur la base du fait que le passage in vitro des embryons en atmosphère riche en oxygène durcit la zone pellucide. Cette technique a d’abord été réalisée en utilisant du Tyrode acide, puis avec des rayons lase. Cette fracturation de la Zona pellucida, censée favoriser l’éclosion des blastocystes et favoriser ainsi l’implantation est inefficace pour les embryons frais. Elle serait +/- efficace pour les embryons congelés du fait d’une augmentation de la dureté de la Zona liée au processus de congélation : Cependant le dernier document « Practice Committee of the American Society for Reproductive Medicine » de juin 2022 indique « There is moderate evidence that assisted hatching does not significantly improve live birth rates in fresh assisted reproductive technology or in patients with poor prognosis or undergoing frozen embryo transfer cycles ». L’éclosion assistée est sans intérêt que ce soit pour les cycles « frais » ou pour les cycles d’embryons congelés
Les marqueurs de qualité pour le moins incertains : Certains « Adds- on » basés sur des données erronées sur la masse embryonnaire et sur sa capacité à secréter des métabolites marqueurs de la qualité embryonnaire à savoir le PAF (Platelet activating factor) et les HLAG n’ont fait qu’une brève apparition bien qu’ayant été publiés dans des revues réputées « sérieuses ». Ils n’ont bien sûr, eu aucun effet ni positif ni négatif.
Les milieux de transfert à viscosité augmentée : Les milieux de transfert UTM et EmbryoGlue, avec de l’acide hyaluronique ne semblent avoir aucun effet, ni positif ni négatif. Dans les études présentées, le biais majeur est le nombre d’embryons transférés qui ne permet pas une analyse rationnelle (Bontekoe et al. 2014, Loutradi et al. 2007). Ces milieux augmentent le prix de la FIV, sans bénéfice associé.
CONCLUSION
L’expansion de la procréation médicalement assistée a provoqué l’apparition d’ajouts « adds on » dont certains ont été positifs, d’autres négligés, malgré un apport réel : coculture (Veiga et al 1999, Spandorfer et al. 2004, Kattal et al 2008), mico-injection avec acide hyaluronique, pour a minima éviter le PVP (Parmegiani et al. 2010, 2012) voir plus loin. D’autres ont été assez neutres (assisted Hatching), sauf pour le cout pour les patients. D’autres ont spontanément disparus (IMSI) et d’autres enfin qui se sont révélés toxiques.
Parmi les positifs, il faut saluer bien sur l’avènement de l’ICSI, qui a permis des progrès certains pour les couples infertiles d’origine masculine, même si l’on ne connait pas tous les aspects futurs pour les enfants. Les études sont quand même très positives et plutôt encourageantes. La conséquence à malheureusement été une chute des études andrologiques. Cependant des concepts associés comme la fragmentation et la décondensation de l’ADN spermatique ont été d’un apport certain. Dans ce cadre, on peut aussi citer la micro-injection avec sélection à l’acide hyaluronique (Parmegiani et al. 2010, 2012), plus physiologique, sachant que la PVP classiquement utilisé en ICSI, n’est pas un produit dégradable. Elle donne des résultats au moins équivalents à ceux obtenus par injection avec PVP.
Enfin, 3 nouvelles applications posent des problèmes : le PGT-A, l’ERA, la toxicité des aminoacides essentiels. Pour les deux premières, il semble évident qu’elles ont pénalisé les patients tant d’un point de vue financier que du simple fait des grossesses perdues. PGT-A n’apporte rien, sinon un stress majeur à l’embryon. La qualité des milieux de culture et l’impact sur l’empreinte et l’épigénèse pose un réel problème. Nous ne reviendrons pas sur le problème majeur posé par le concept de la « toxicité » des aminoacides essentiels (notamment soufrés) et l’impact sur le maintien des marques épigénétiques ; mais cet aspect, clairement décrit par Market Velker et al2010,2012, et Dvoran et al. 2022 rend illisible/inaudible l’intérêt du time Lapse (cinétique du développement embryonnaire…. etc) réalisé dans de tels milieux.
Il est temps de prendre en compte certaines hérésies physiologiques et biochimiques qui pénalisent les patients tant en termes financiers qu’en termes de perte de grossesse voir de santé des enfants.
Références :
- Gleicher N, Barad DH, Patrizio P & Orvieto R. We have reached a dead end for preimplantation genetic testing for aneuploidy. Hum Reprod. 2022:deac052.
- Gleicher N, Patrizio P & Brivanlou A. Preimplantation Genetic Testing for Aneuploidy - a Castle Built on Sand Trends Mol Med. 2021 ;27(8):731-742.
- Cozzolino M, Diáz-Gimeno P, Pellicer A, Garrido N. Use of the endometrial receptivity array to guide personalized embryo transfer after a failed transfer attempt was associated with a lower cumulative and per transfer live birth rate during donor and autologous cycles. Fertil Steril. 2022;118(4):724-736.
- Helosvuori E & Homanen R When craft kicks back: Embryo culture as knowledge production in the context of the transnational fertility industry.. Soc Stud Sci. 2022 ;52(3):425-446.
- Park H, Bergh C, Selleskog U, Thurin-Kjellberg A & Lundin K No benefit of culturing embryos in a closed system compared with a conventional incubator in terms of number of good quality embryos: results from an RCT. Hum Reprod. 2015 ;30(2):268-75.
Armstrong S, Bhide P, Jordan V, Pacey A, Marjoribanks J & Farquhar C Time-lapse systems for embryo incubation and assessment in assisted reproduction. Cochrane Database Syst Rev. 2019 ;5(5):CD011320.
Takenaka M, Horiuchi T, Yanagimachi R. Effects of light on development of mammalian zygotes Proc Natl Acad Sci U S A. 2007;104(36):14289-93. - Bontekoe S, Heineman MJ, Johnson N, Blake D. Adherence compounds in embryo transfer media for assisted reproductive technologies. Cochrane Database Syst Rev. 2014 (2):CD007421
Campugan CA, Lim M, Chow DJX, Tan TCY, Li T, Saini AA, Orth A, Reineck P, Schartner EP, Thompson JG, Dholakia K & Dunning KR The effect of discrete wavelengths of visible light on the developing murine embryo. .J Assist Reprod Genet. 2022;39(8):1825-1837 - Cassuto NG, Montjean D, Siffroi JP, Bouret D, Marzouk F, Copin H, Benkhalifa M. Different Levels of DNA Methylation Detected in Human Sperms after Morphological Selection Using High Magnification Microscopy. Biomed Res Int. 2016;2016:6372171
Choux, C.; Binquet, C.; Carmignac, V.; Bruno, C.; Chapusot, C.; Barberet, J.; Lamotte, M.; Sagot, P.; Bourc’his, D.; Fauque, P. The epigenetic control of transposable elements and imprinted genes in newborns is affected by the mode of conception: ART versus spontaneous conception without underlying infertility. Hum. Reprod. 2018, 33, 331–340.
Clare CE, Pestinger V, Kwong WY, Tutt DAR, Xu J, Byrne HM, Barrett DA, Emes RD, Sinclair KD Interspecific Variation in One-Carbon Metabolism within the Ovarian Follicle, Oocyte, and Preimplantation Embryo: Consequences for Epigenetic Programming of DNA Methylation. .Int J Mol Sci. 2021;22(4):1838. - Coutifaris C, Myers ER, Guzick DS, Diamond MP, Carson SA, Legro RS, et al. Histological dating of timed endometrial biopsy tissue is not related to fertility status. Fertil Steril 2004; 82:1264–72.
Cozzolino M, Diaz-Gimeno P, Pellicer A, Garrido N. valuation of the endometrial receptivity assay and the preimplantation genetic test for aneuploidy in overcoming recurrent implantation failure J Assist Reprod Genet. 2020;37(12):2989-2997. - Cozzolino M, Diáz-Gimeno P, Pellicer A, Garrido N. Use of the endometrial receptivity array to guide personalized embryo transfer after a failed transfer attempt was associated with a lower cumulative and per transfer live birth rate during donor and autologous cycles. Fertil Steril. 2022 ;118(4):724-736.
- Dvoran, M.; Nemcova, L.; Kalous, J. An Interplay between Epigenetics and Translation in Oocyte Maturation and Embryo Development: Assisted Reproduction Perspective. Biomedicines 2022, 10, 1689.
- Gardner DK, LaneM. Culture and selection of viable blastocysts: a feasible proposition for human IVF? Hum Reprod Update. 1997;3: 367–82.
- Gleicher N, Barad DH, Patrizio P & Orvieto R. We have reached a dead end for preimplantation genetic testing for aneuploidy. Hum Reprod. 2022:deac052.
- Gleicher N, Patrizio P & Brivanlou A. Preimplantation Genetic Testing for Aneuploidy - a Castle Built on Sand Trends Mol Med. 2021 ;27(8):731-742.
- Håberg, S.E.; Page, C.M.; Lee, Y.; Nustad, H.E.; Magnus, M.C.; Haftorn, K.L.; Carlsen, E.; Denault, W.R.P.; Bohlin, J.; Jugessur, A.; et al. DNA methylation in newborns conceived by assisted reproductive technology. Nat. Commun. 2022, 13, 1896.
- Hattori, H.; Hiura, H.; Kitamura, A.; Miyauchi, N.; Kobayashi, N.; Takahashi, S.; Okae, H.; Kyono, K.; Kagami, M.; Ogata, T.; et al. Association of four imprinting disorders and ART. Clin. Epigenetics 2019, 11, 21.
- Helosvuori E & Homanen R When craft kicks back: Embryo culture as knowledge production in the context of the transnational fertility industry.. Soc Stud Sci. 2022 ;52(3):425-446.
- Ho Y, Wigglesworth K, Eppig JJ, Schultz RM Preimplantation development of mouse embryos in KSOM: augmentation by amino acids and analysis of gene expression. Mol Reprod Dev. 1995;41(2):232-8.
- Kattal N, Cohen J, Barmat LI. Role of coculture in human in vitro fertilization: a meta-analysis. Fertil Steril. 2008;90(4):1069-76
- Lane M, Hooper K, Gardner DK. Effect of essential amino acids on mouse embryo viability and ammonium production. J Assist Reprod Genet. 2001; 18:519–25.
- Lane M, Gardner DK. Nonessential amino acids and glutamine decrease the time of the first three cleavage divisions and increase compaction of mouse zygotes in vitro. J Assist Reprod Genet. 1997; 14:398–403.
Lazaraviciute, G .; Kauser, M.; Bhattacharya, S.; Haggarty, P.; Bhattacharya, S. A systematic review and meta‐analysis of DNA methylation levels and imprinting disorders in children conceived by IVF/ICSI compared with children conceived spontaneously. Hum. Reprod. Update 2014, 20, 840–852. - Leese HJ, McKeegan PJ, Sturmey RG.Amino Acids and the Early Mammalian Embryo: Origin, Fate, Function and Life-Long Legacy. Int J Environ Res Public Health. 2021 ;18(18):9874
- Loutradi KE, Prassas I, Bili E, Sanopoulou T, Bontis I, Tarlatzis BC. Evaluation of a transfer medium containing high concentration of hyaluronan in human in vitro fertilization.Fertil Steril. 2007;87(1):48-52.
- Market‐Velker, B.A.; Fernandes, A.D.; Mann, M.R. Side‐by‐side comparison of five commercial media systems in a mouse model: Suboptimal in vitro culture interferes with imprint maintenance. Biol. Reprod. 2010, 83, 938–950.
- Market Velker, B.A.; Denomme, M.M.; Mann, M.R. Loss of genomic imprinting in mouse embryos with fast rates of preimplantation development in culture. Biol. Reprod. 2012, 86, 1–16.
Martín-Romero FJ, Miguel-Lasobras EM, Domínguez-Arroyo JA, González-Carrera E, Alvarez IS. Contribution of culture media to oxidative stress and its effect on human oocytes.
Reprod Biomed Online. 2008;17(5):652-61 - Ménézo YJ, Dale B, Cohen M. DNA damage and repair in human oocytes and embryos: a review.Zygote. 2010, 18(4):357-65.
- Menezo YJ, Silvestris E, Dale B, Elder K Oxidative stress and alterations in DNA methylation: two sides of the same coin in reproduction..Reprod Biomed Online. 2016;33(6):668-683.
Murray MJ, Meyer WR, Zaino RJ, Lessey BA, Novotny DB, Ireland K, et al. A critical analysis of the accuracy, reproducibility, and clinical utility of histologic endometrial dating in fertile women. Fertil Steril 2004;81:1333–43 - Park H, Bergh C, Selleskog U, Thurin-Kjellberg A, Lundin K; No benefit of culturing embryos in a closed system compared with a conventional incubator in terms of number of good quality embryos: results from an RCT. .Hum Reprod. 2015 ;30(2):268-75
- Parmegiani L, Cognigni GE, Bernardi S, Troilo E, Taraborrelli S, Arnone A, Maccarini AM, Filicori M. Comparison of two ready-to-use systems designed for sperm-hyaluronic acid binding selection before intracytoplasmic sperm injection: PICSI vs. Sperm Slow: a prospective, randomized trial. Fertil Steril. 2012 ;98(3):632-7.
- Parmegiani L, Cognigni GE, Bernardi S, Troilo E, Ciampaglia W, Filicori M. "Physiologic ICSI": hyaluronic acid (HA) favors selection of spermatozoa without DNA fragmentation and with normal nucleus, resulting in improvement of embryo quality. Fertil Steril. 2010;93(2):598-604
- Patrizio P, Shoham G, Shoham Z, Leong M, Barad DH, Gleicher N Worldwide live births following the transfer of chromosomally "Abnormal" embryos after PGT/A: results of a worldwide web-based survey. J Assist Reprod Genet. 2019, ;36(8):1599-1607
Schultz RM. Of light and mouse embryos: less is more. PNAS. 2007 ;104:14547–8.
Spandorfer SD, Pascal P, Parks J, Clark R, Veeck L, Davis OK, Rosenwaks Z Autologous endometrial coculture in patients with IVF failure: outcome of the first 1,030 cases.
J Reprod Med. 2004 ;49(6):463-7 - Takenaka M, Horiuchi T, Yanagimachi R. Effects of light on development of mammalian zygotes Proc Natl Acad Sci U S A. 2007;104(36):14289-93.
- Veiga A, Gil Y, Boada M, Carrera M, Vidal F, Boiso I, Ménézo Y, Barri PN. Confirmation of diagnosis in preimplantation genetic diagnosis (PGD) through blastocyst culture: preliminary experience. Prenat Diagn. 1999;19(13):1242-7.
- Veiga A, Torelló MJ, Ménézo Y, Busquets A, Sarrias O, Coroleu B, Barri PN. Use of co-culture of human embryos on Vero cells to improve clinical implantation rate. Hum Reprod. 1999 ;14 Suppl 2:112-20







